Les projets soutenus par Neurochlore
L’identification des répondeurs à la Bumétanide grâce à l’intelligence artificielle
Hier…
Plusieurs essais cliniques indépendants, ainsi que nos deux études de phase II menées sur plus de 120 enfants atteints de troubles du spectre autistique (TSA) (Lemonnier et al., 2012 ; 2017), ont évalué l’efficacité de la Bumétanide. Ces travaux ont mis en évidence des effets positifs, renforçant l’intérêt de cette molécule comme option thérapeutique potentielle. Ils ont été validés dans 7 autres essais menés par des équipes de différents pays avec plus de 1036 enfants traités avec succès par cette approche (Xiao, Hong-Li, et al. 2024)
Nos articles sur les phases II.a et II.b :
Sur la base de ces résultats encourageants, Neurochlore, en collaboration avec les Laboratoires Servier, a lancé une étude de phase III approuvée par les autorités européennes. L’objectif était de confirmer l’efficacité de la Bumétanide dans le traitement des TSA et de préparer une demande d’autorisation de mise sur le marché en Europe.

Le détail des études phase III sont accessibles sur les sites :
- Pour l’étude des enfants âgés de 2 ans à moins de 7 ans : https://clinicaltrials.gov/ct2/show/NCT03715153
- Pour l’étude des enfants âgés de 7 ans à moins de 18 ans : https://clinicaltrials.gov/ct2/show/NCT03715166
Cependant, les résultats de cette phase III n’ont pas démontré de différence significative entre le groupe traité et le groupe placebo. Les critères d’évaluation clinique n’ont pas atteint le seuil requis, empêchant ainsi la validation de l’étude et la mise sur le marché du traitement.
À ce jour, tous les essais cliniques de phase III portant sur les troubles neurodéveloppementaux se sont soldés par un échec, en grande partie en raison de l’importante hétérogénéité des troubles, de la diversité des profils de patients et de la complexité même de ces pathologies.
Les TSA se caractérisent par cette hétérogénéité clinique marquée, tant au niveau des symptômes que de leur sévérité. Ce spectre englobe des manifestations variées, comme des difficultés dans les interactions sociales, la communication et l’altération du comportement. De plus, la présence de comorbidités, telles que l’épilepsie ou les troubles anxieux, accentue cette variabilité, compliquant l’évaluation des traitements.
Bien que la phase III n’ait pas démontré de bénéfice significatif pour l’ensemble des patients, la Bumétanide reste une piste thérapeutique prometteuse pour les TSA. Les résultats des phases II, les retours des cliniciens et les analyses statistiques suggèrent que certains sous-groupes de patients pourraient bénéficier du traitement. (Lire la note d’information sur la réutilisation des données)

… Aujourd’hui
Dans cette optique, Neurochlore a initié un projet visant à identifier ces répondeurs potentiels au sein de la population de la phase III, afin de mieux comprendre les facteurs influençant l’efficacité de la Bumétanide et d’optimiser son utilisation future.
En s’appuyant sur l’expertise de B&A Biomedical en analyse de données cliniques et en intelligence artificielle, nous avons réanalysé les données de cette phase III en tirant parti des nouvelles méthodes computationnelles de machine learning. L’objectif est d’identifier d’éventuels sous-groupes de « Répondeurs », pour lesquels les critères d’évaluation atteignent les seuils requis et présentant pour les patients traités avec la Bumétanide une amélioration significativement supérieure au groupe placebo.
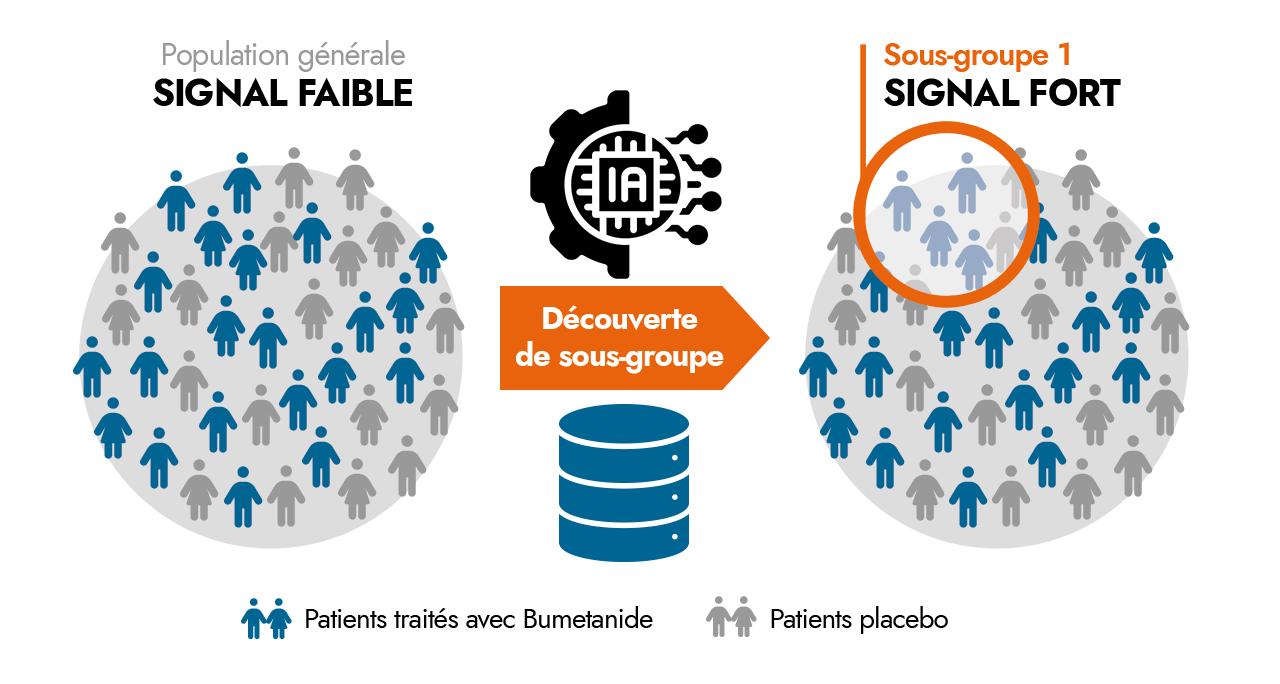
Cette approche nous a permis d’identifier des sous-groupes montrant une réponse positive au traitement pour environ 30 à 40 % de la population de cet essai.
Ces sous-groupes de patients sont définis à partir de critères cliniques relatifs aux échelles d’évaluation de ces troubles neurodéveloppementaux.
Encouragés par ces résultats prometteurs, nous explorons différentes possibilités de levées de fonds et d’investissements afin de mener une nouvelle étude ciblée, fondée sur ces critères d’inclusion optimisés. Cette dernière, menée sur une nouvelle population (une cinquantaine de sujets) recrutée selon les critères identifiés dans ces analyses, permettrai de valider ces résultats avant d’initier un nouvel essai clinique ciblé pour une mise sur le marché du 1er traitement de l’autisme.
Au-delà de cette étude, cette approche innovante apporte un regard nouveau quant à l’optimisation des essais cliniques avec des perspectives d’application à d’autres pathologies complexes.


