Les projets soutenus par Neurochlore
Une approche combinée pour le traitement des tumeurs cérébrales
Contexte
Malgré des investissements colossaux et des avancées majeures, il n’existe toujours pas de traitement réellement efficace contre les tumeurs cérébrales. Les approches conventionnelles, comme la chimiothérapie et la radiothérapie, ne font que prolonger légèrement la survie des patients, souvent au prix d’effets secondaires sévères. Quant aux stratégies émergentes, telles que la thérapie par champs électriques (TTF) ou l’immunothérapie, elles restent coûteuses, incertaines et difficiles à généraliser, posant un défi financier majeur, en particulier pour les systèmes de santé et les pays à faibles ressources.
L’une des raisons fondamentales de ces échecs réside dans le manque de considération du micro-environnement tumoral, notamment la relation étroite entre l’environnement neuronal et la tumeur.
Des études récentes ont montré que les cellules tumorales établissent des connexions synaptiques fonctionnelles avec les neurones environnants, générant une hyperactivité qui favorise leur prolifération et leur dissémination métastatique (Barron, Tara, et al. 2025). Un acteur clé de ce phénomène est la polarité GABAergique altérée dans les cellules tumorales. Contrairement aux neurones matures où le GABA est inhibiteur, les cellules cancéreuses accumulent des niveaux anormalement élevés de chlorure intracellulaire, principalement en raison d’une surexpression de NKCC1. Cette altération transforme le GABA en un signal excitateur, favorisant la croissance tumorale au lieu de la freiner
Ignorer cette dynamique complexe, propre aux réseaux cérébraux, limite considérablement l’efficacité des traitements actuels. Cibler spécifiquement ces interactions neuronales et restaurer une polarité GABAergique normale pourrait offrir une approche novatrice et plus efficace pour lutter contre les tumeurs cérébrales.
Projet
Face à ce constat, Neurochlore a initié un projet proposant une stratégie combinée innovante, reposant sur l’action synergique de deux molécules : la Bumétanide, un inhibiteur de NKCC1 qui vise à bloquer l’hyperactivité neuronale associée à la tumeur, et le Mébendazole (MBZ), un agent antiparasitaire connu pour sa capacité à cibler les microtubules et à induire la destruction des cellules tumorales. Ce dernier a déjà démontré son potentiel anticancéreux à travers de nombreuses études expérimentales et une phase I/II menée sur des patients atteints de glioblastome par une équipe de l’université Johns Hopkins (Gallia, Gary L., et al. 2021).
Bumetanide (BUM)
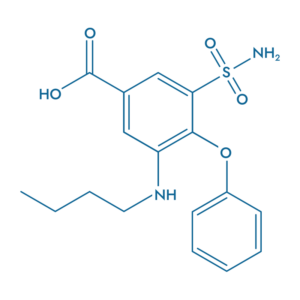
- Bloque l’hyperactivité
- Prévient les métastases
Mebendazole (MBZ)
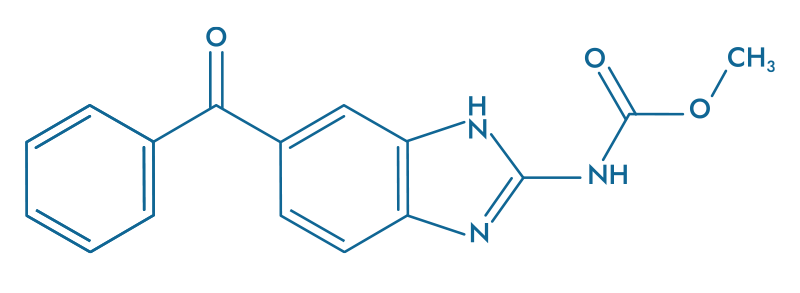
- Détruit les microtubules
- Tue les cellules tumorales
En combinant ces deux approches complémentaires, notre objectif est de proposer un traitement plus efficace et mieux toléré, en agissant non seulement sur la tumeur elle-même, mais aussi sur son environnement, clé de sa progression.
En s’appuyant sur l’expertise de B&A Oncomedical dans divers champs d’application ex vivo et in vitro, allant de la culture cellulaire aux techniques d’électrophysiologie avancées, ainsi que sur des collaborations fructueuses avec le Pr F. Berger et ses équipes à Grenoble, notre objectif est d’évaluer le potentiel de cette combinaison thérapeutique dans le traitement du glioblastome, une tumeur cérébrale maligne très agressive.
Compte tenu des mécanismes d’action distincts du Mébendazole et de la Bumétanide , nous avons évalué les effets de leur combinaison sur plusieurs modèles expérimentaux.
Les glioblastomes perturbent l’équilibre neuronal et favorisent une hyperexcitabilité synaptique, conduisant à l’apparition de crises épileptiformes similaires à celles observées dans l’épilepsie. Nos recherches sur des tumeurs fraîchement réséquées de patients, enregistrées avec les techniques physiologiques les plus avancées – incluant, pour la première fois, des mesures directes des canaux GABA individuels et des taux de chlorure intracellulaire (Cl⁻) – nous ont permis d’explorer en profondeur ces interactions. Nous avons démontré que la Bumétanide en présence Mébendazole bloque complètement les crises épileptiformes dans des tranches corticales tumorales et ce à faible concentration.
Résultats
Des observations similaires, où l’association des deux médicaments s’est révélée plus efficace que chaque molécule administrée seule, ont également été obtenues dans des modèles de tumeurs cérébrales « tumoroides », ou encore sur des tranches de cerveaux murins.
Cette synergie permet non seulement d’éliminer des cellules tumorales, mais aussi de réduire significativement l’hyperexcitabilité neuronale. De plus, cette interaction permettrait d’utiliser des doses plus faibles des deux composés, limitant ainsi les effets secondaires potentiels et améliorant la tolérance du traitement.
Enfin, dans le cadre d’un essai pilote compassionnel, l’administration du combo chez un patient a montré une augmentation remarquable de l’espérance de vie.
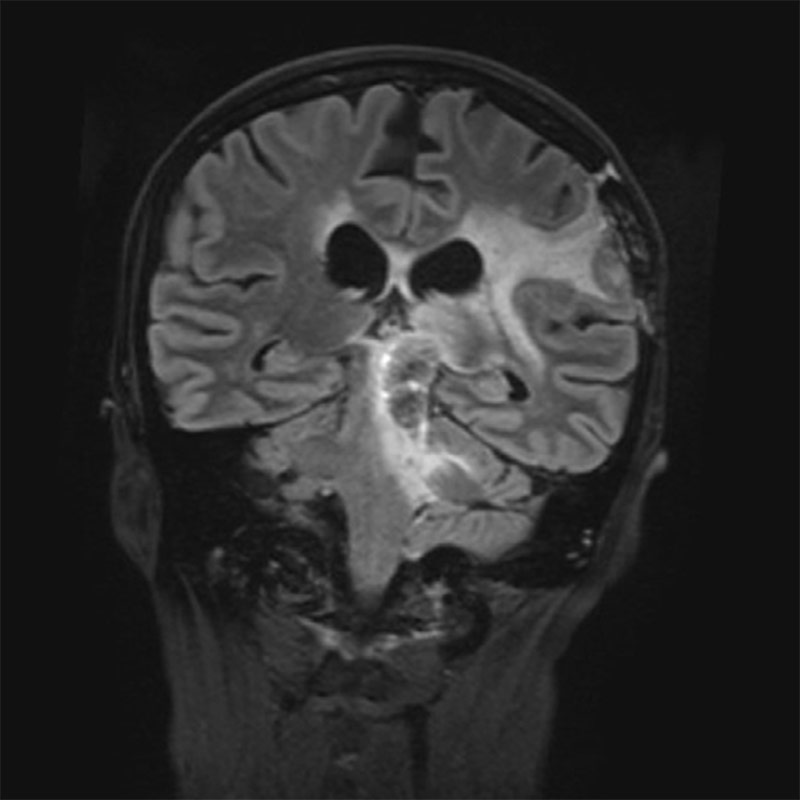
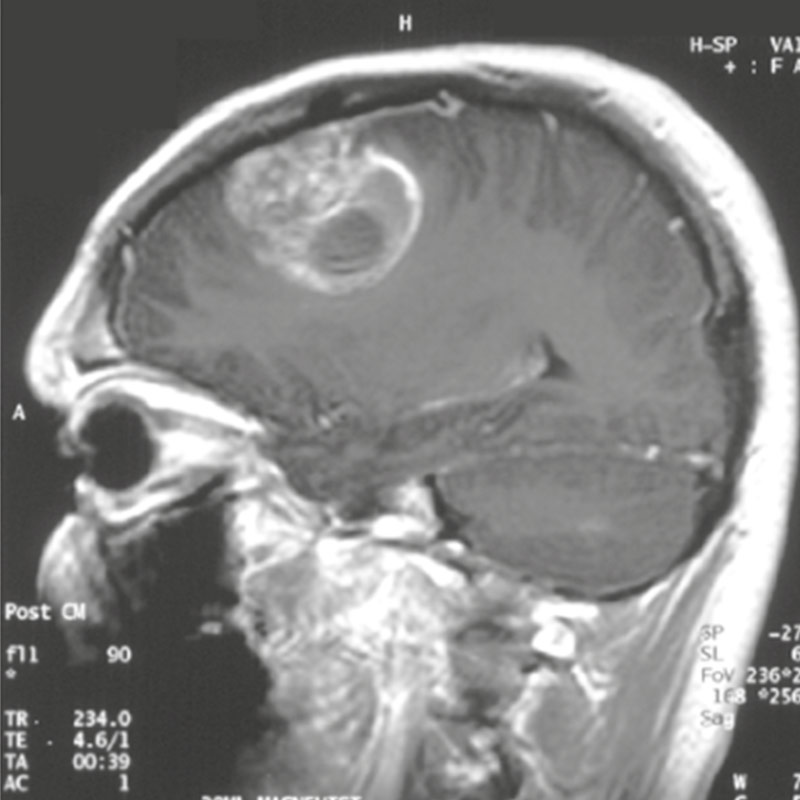
Ces résultats prometteurs, couverts par une demande PCT, ouvrent la voie à une approche thérapeutique innovante, ciblant à la fois les cellules tumorales et leur environnement neuronal, avec des perspectives d’application potentielles à d’autres tumeurs cérébrales. Notre objectif est désormais de sécuriser des financements et de mobiliser des investisseurs afin de lancer un essai clinique de phase 2/3 évaluant l’efficacité de la combinaison BUM x MBZ pour le traitement des glioblastomes et d’autres tumeurs du cerveau.


