Les projets soutenus par Neurochlore
Développement de nouveaux inhibiteurs de NKCC1 : une approche aux applications multiples
Contexte
Le transporteur NKCC1 joue un rôle clé dans de nombreux processus physiopathologiques, notamment dans l’hyperexcitabilité neuronale, les troubles neurodéveloppementaux, et la croissance tumorale. Son inhibition représente une stratégie thérapeutique prometteuse avec des applications multiples, allant du traitement des troubles du spectre autistique (TSA) et de l’épilepsie, jusqu’à la lutte contre les tumeurs cérébrales et d’autres pathologies où l’homéostasie du chlorure est altérée.

En collaboration avec des experts de renommée mondiale du co-transporteur NKCC1 et le laboratoire Edelris, leader dans le domaine du développement de nouveaux composés chimiques, Neurochlore a mis au point de nouveaux inhibiteurs de NKCC1, à la fois plus spécifiques et plus efficaces, dans le but d’optimiser leur action thérapeutique tout en minimisant les effets secondaires.
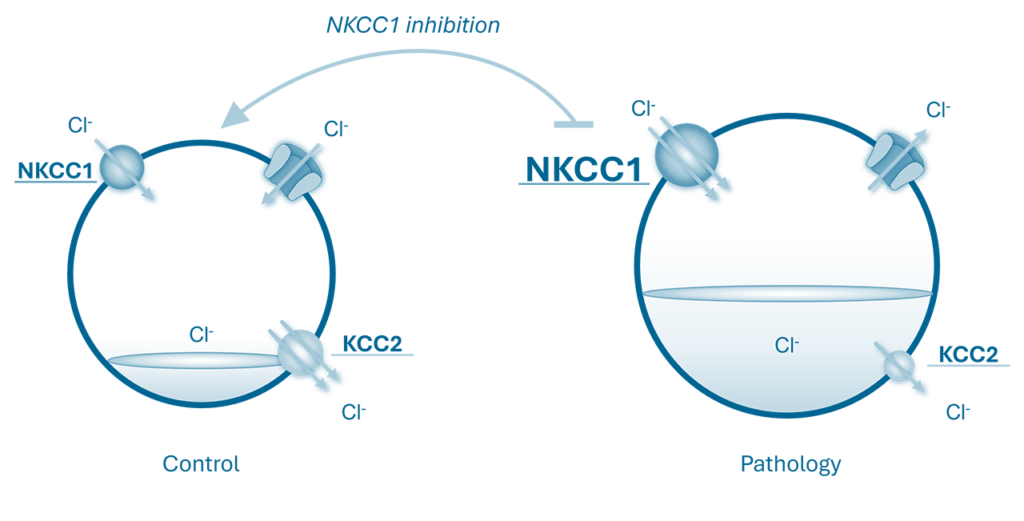
Ces nouveaux composés, dérivés de la Bumétanide — un inhibiteur de NKCC1 connu pour sa capacité à bloquer l’hyperactivité neuronale en inhibant ce co-transporteur — permettent de restaurer les niveaux physiologiques bas de chlore intracellulaire, rétablissant ainsi le rôle inhibiteur du GABA.
Projet & résultats
De ce partenariat sont sortis 120 inhibiteurs propriétaires novateurs du transporteur NKCC1 protégées par brevet.
Tous ces composés ont été initialement évalués pour leur capacité à inhiber NKCC1 sur des lignées cellulaires humaines. La plupart se sont révélés avec des taux d’efficacité variant de 75% à 100% de la molécule de référence la Bumétanide . Cependant, deux composés l’ont même surpassée, atteignant une efficacité de 120%. À notre connaissance, aucun inhibiteur de NKCC1 ne propose des résultats aussi prometteurs sur le marché.
Dans le cadre de notre approche novatrice pour le traitement des tumeurs cérébrales, qui repose sur une combinaison inédite de Bumétanide et de Mébendazole, ces nouveaux composés bloquent l’hyperactivité sans affecter les courants ioniques intrinsèques. Plus surprenant encore, l’efficacité de ces composés dans l’inhibition de l’hyperactivité dans l’environnement tumoral est considérablement renforcée en présence de Mébendazole, connu pour induire la mort des cellules tumorales. Des analyses supplémentaires ont montré que le Mébendazole agit également comme un inhibiteur partiel de NKCC1, suggérant que ces composés pourraient agir non seulement de manière complémentaire, mais également de façon synergique.
Il est essentiel de souligner que l’altération de l’homéostasie du chlorure liée au transporteur NKCC1 est impliquée dans de nombreuses pathologies, et que plusieurs études ont suggéré des améliorations considérables suite à son inhibition.
Par exemple, dans la maladie d’Alzheimer, des recherches récentes ont démontré que la prise de Bumétanide sur le long terme réduisait le risque de développer cette maladie par un facteur de trois, sur la base de données collectées auprès de 5 millions de citoyens américains âgés de plus de 65 ans (Taubes, Alice, et al. 2022) . En effet, la Bumétanide a été qualifiée de « traitement le plus prometteur contre Alzheimer » parmi plus de 1 000 agents largement utilisés.
La découverte de ces nouveaux inhibiteurs de NKCC1 représente donc une avancée majeure, susceptible d’ouvrir la voie à une révolution thérapeutique en ciblant des mécanismes fondamentaux impliqués dans de nombreuses maladies neurologiques et oncologiques.
Fort de ces résultats prometteurs, notre objectif à présent est de sélectionner les cinq principaux antagonistes novateurs du NKCC1 et de mener à bien les études préalables à l’IND devant mener à une phase 1, dans le but de traiter le glioblastome et d’autres tumeurs cérébrales, et une large liste d’autres maladies.


