Essais cliniques
Qu’est-ce qu’un essai clinique ?
Un essai clinique a pour but de tester l’efficacité et les effets secondaires d’un nouveau traitement qui aura l’autorisation d’être mis sur le marché. Les essais cliniques sont précédés par des phases de recherche préclinique sur des modèles animaux et des approches in vitro afin de valider son innocuité, la liste de ses effets secondaires et son efficacité dans la réduction du syndrome. Cette procédure prend souvent de nombreuses années.
Quelles sont les différentes phases des essais cliniques ?
La recherche préclinique :
Consiste en l’étude de la molécule, sa structure, son effet sur les cellules, son effet sur l’animal au niveau comportemental et biologique, l’étude des organes-cibles. Elle se réalise in vitro puis in vivo sur des modèles animaux, généralement des rongeurs (souris et rats).
Phase I :
A pour but d’évaluer la tolérance et l’absence d’effets indésirables chez des sujets le plus souvent volontaires sains. Les groupes étudiés sont le plus souvent de petite taille (moins de 100 participants). L’absence d’effets secondaires majeurs conditionne la poursuite de l’essai.
Phase II :
La phase II ou « étude pilote », consiste à déterminer la dose optimale du médicament et ses éventuels effets indésirables. Les groupes étudiés sont de taille moyenne (souvent de 100 participants). Deux groupes de patients sont constitués par tirage au sort (randomisation), de manière à constituer des groupes homogènes et comparables (âge, sexe, caractéristiques de la maladie…) : l’un recevra le traitement de référence ou placebo et l’autre le nouveau traitement. Dans certains cas, les patients ne sauront pas quel est le traitement reçu, on parle alors d’essai en aveugle. On emploie le terme « double aveugle » lorsque ni le patient, ni le personnel soignant ne savent quel traitement est donné.
Phase III :
La phase III ou « étude pivot », est l’étude comparative d’efficacité proprement dite. Elle compare le traitement soit à un placebo soit à un traitement de référence, en double aveugle randomisé, sur des groupes de taille importante (des centaines voire des milliers de participants) et ce dans plusieurs centres de référence. Les résultats de l’étude sont évalués par les autorités européennes et américaines pour une demande d’autorisation de mise sur le marché du médicament ou traitement.
Phase IV :
La phase IV, ou « post-marketing » est le suivi à long terme d’un traitement alors que le traitement est autorisé sur le marché. Cela doit permettre de dépister des effets secondaires rares ou des complications tardives. Cette phase de surveillance étroite est appelée « pharmacovigilance ». Elle est à la charge des laboratoires.
Neurochlore et ses essais cliniques
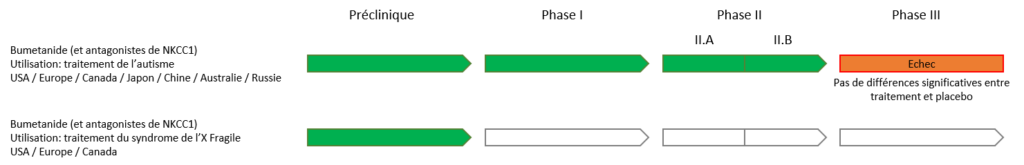
Des essais cliniques encourageants ont été effectués sur plus de 120 enfants atteints de Troubles du Spectre de l’Autisme en utilisant la Bumétanide. Plusieurs études indépendantes ont validé l’efficacité de la Bumétanide sur les TSAs. Deux essais cliniques de phase II.a et II.b (Lemonnier et al, 2012 et 2017) ont été effectués sur plus de 120 enfants atteints de Troubles du Spectre de l’Autisme (TSA) en utilisant la Bumétanide et ont donné des résultats positifs. Ensuite, plusieurs études indépendantes ont validé l’efficacité de cette molécule sur les TSA. Ceci a permis de passer à la phase III approuvée par les autorités Européennes. Neurochlore a signé avec les Laboratoires Servier un partenariat de licence lui concédant les droits de développement et commercialisation en Europe.
La phase III avait pour but de valider l’efficacité de la Bumétanide et de déposer une demande de mise sur le marché en Europe. L’essai, divisé en 2 sous-groupes (2 à 7 ans et <7 à 18 ans), a inclus 420 enfants recrutés dans 40 centres en Europe/Brésil/Australie et USA. Ils étaient répartis en « sous traitement (0.5mg) » et « sous placebo » pendant 6 mois. Malheureusement, les résultats ont été négatifs, sans différences significatives entre traités et placébo dans le critère principal et les critères secondaires, pour les deux groupes d’âge.
Le détail des études phase III sont accessibles sur les sites :
- Pour l’étude des enfants âgés de 2 ans à moins de 7 ans : https://clinicaltrials.gov/ct2/show/NCT03715153
- Pour l’étude des enfants âgés de 7 ans à moins de 18 ans : https://clinicaltrials.gov/ct2/show/NCT03715166

Nos articles sur les phases II.a et II.b :
La Bumétanide a été administrée sous forme liquide, approuvée et testée dans les phases 2 et 3.
Les flacons sont dosés pour 1 mois (1mg matin et soir).
La phase II.B qui vérifie l’efficacité et détermine la dose optimale a réussi, mais la phase III n’a malheureusement pas montré de réelle différence entre la Bumétanide et un placébo.
Ce résultat nous empêchant de trouver de futurs investisseurs, Neurochlore va donc arrêter ses essais cliniques.
